Tensioactifs – Agents de surface
Par Aziz Lallam – Abdelaziz.lallam@uha.fr – ENSISA, 11 rue Alfred Werner 68093 Mulhouse
Introduction
Le sujet développé dans cet article est essentiellement destiné aux élèves ingénieurs et aux techniciens du textile. Il traite de la problématique des tensioactifs et de leur utilité dans divers domaines d’applications. Cet article est en deux parties, la première est développée dans ce numéro du guide de l’Ennoblisseur, la seconde sera traitée dans la prochaine édition de la Newsletter. Dans le cas présent, nous nous proposons de donner une définition des tensioactifs, de présenter les différents types de tensioactifs et leurs propriétés générales. Dans le second article nous nous intéresserons aux relations spécifiques entre la tension superficielle et les tensioactifs, d’une part, et la mesure de tension superficielle d’autre part, afin d’expliquer le phénomène de la mouillabilité et de son importance dans l’ennoblissement. Nous nous intéresserons à la classification des tensioactifs via la notion de HLB et nous proposerons une méthode de son calcul.
La dénomination ‘’agents tensioactifs’’ provient de l’industrie textile. La culture de cette profession est plus ou moins conservée pour définir les domaines d’applications de ces agents. Dans la littérature Anglo-Saxonne, les tensioactifs sont qualifiés de surfactants. Leur rôle principal consiste à disperser et à dissoudre les corps gras présents en milieux aqueux. Selon la valeur de la balance hydrophile/lipophile (HLB), ils peuvent être mouillants, moussants, détergents, lubrifiants, anti-mousse etc. Ainsi, les tensioactifs possèdent le pouvoir de modifier la tension superficielle de surfaces en contact. Cette propriété spécifique les rend indispensables dans de nombreuses applications industrielles. L’emploi de ces produits est courant dans l’industrie textile notamment dans le domaine de l’ennoblissement en tant qu’agent mouillant dans les prétraitements et dans la teinture. Parfois, ils sont utilisés en tant qu’agent anti-mousse et toujours en tant que détergent dans les opérations de lavage industriel.
La structure chimique des tensioactifs leur confère une double affinité à la fois pour les corps gras et pour l’eau. C’est cette remarquable propriété qui leur permet de solubiliser et mélanger deux phases liquides initialement non miscibles.
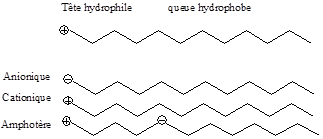
Mis en solution dans l’eau, les tensioactifs s’organisent aux interfaces en orientant la parie hydrophile de leur molécule vers l’eau et la partie hydrophobe vers la phase organique huileuse ou vers l’air comme le montre le schéma ci-après :
1. Les différents types de tensioactifs
Les tensioactifs peuvent être d’origine végétale ou synthétique. On peut les classés sommairement en quatre types de tensioactifs selon la nature de la partie hydrophile du produit comme l’indique le schéma suivant :
2. Quelques exemples de tensioactifs selon la composante hydrophile
|
Tensioactifs Anioniques
|
sulfates d’alcools gras, sulfates d’alcools gras éthoxylés (éthersulfates), alkylarènes sulfonates, |
|
Tensioactifs cationiques
|
sels d’amines et de polyamines grasses acryliques et hétérocycliques, |
|
Tensioactifs non ioniques |
éthoxylats et propoxylats |
|
Tensioactifs amphotères ou zwitterioniques |
bétaïnes, |
3. Quelques propriétés des tensioactifs
|
Détergence |
Aident à éliminer les souillures et les salissures et améliorent leur dispersion dans l’eau (lavage des textiles) |
|
Dispersion |
Ils augmentent la stabilité de suspension de petites particules solides dans un liquide. |
|
Emulsion |
Ils facilitent la formation d’une émulsion, c’est-à-dire une dispersion sous forme de fines gouttelettes d’un liquide dans un autre (huile dans eau par exemple) et en augmentent la stabilité. |
|
Mouillage |
Ils favorisent l’étalement d’un liquide sur une surface solide ou augmentent sa vitesse de pénétration dans les corps poreux (coton, cuir, papier, …). |
|
Moussage et anti-moussage |
Ils réduisent ou empêchent la formation de mousse. |
|
Solubilisation |
Ils améliorent la solubilité dans l’eau de corps peu solubles. |
Ces différentes propriétés font des tensioactifs des éléments essentiels dans des domaines d’application très variés.
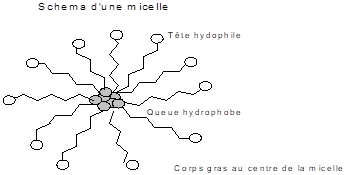
4. Tensioactifs et structures micellaires
La propriété principale des tensioactifs est l’aptitude de s’auto-organiser. Cette tendance est caractérisée par la concentration critique micellaire [CMC] de l’agent tensioactif. La [CMC] est la concentration du tensioactif nécessaire pour obtenir une structure micellaire.
A une concentration inférieure à la [CMC], le tensioactif forme un film à la surface du liquide et le restant du tensioactif se trouve dispersé dans la solution. Lorsque la concentration atteint la [CMC] tout ajout de tensioactif conduit à la formation micelles sphériques.
5.Concentration micellaire critique et activité de surface
L’activité de surface, As, peut-être définie de manière empirique par la relation suivante :
As = [Cs]/[Cv]
Avec [Cs] concentration à la surface et [Cv] la concentration en volume d’une substance donnée.
Pour les agents tensio-actifs à la concentration micellaire critique, l’activité de surface est :
As = [Cs]/[Cv] = 1000
Pour un système donné, si la concentration de l’agent de surface augmente, la tension superficielle diminue jusqu’à une valeur constante. La relation entre l’activité de surface et la [CMC] est exprimée par l’équation et le graphe suivants :
As = ϒ0 – ϒCMC/[CMC]
ϒ0 : tension de surface du milieu eau par exemple
ϒCMC tension de surface à la concentration micellaire critique
Le graphe montre que la tension superficielle ne varie plus avec la concentration au de-là de la CMC. C’est la concentration à laquelle apparaissent les structures micellaires. La valeur de la CMC dépond, dans une certaine mesure, de la température de l’utilisation du tensioactif. Dans le tableau suivant nous consignons les valeurs de la CMC en fonction de la température pour quelques agents tensioactifs.
|
Agents tensioactifs |
CMC à 50°c |
CMC à 25 °C |
CMC à 30 °C |
|
Stéarate de Potassium |
0,45.10-3 |
|
|
|
Oléate de potassium |
1,2.10-3 |
|
|
|
Elaïdate de potassium |
1,6.10-3 |
|
|
|
Laurate de potasium |
|
12,5.10-3 |
|
|
Lauryl sulfate de potassium |
|
9,5.10-3 |
|
|
Lauryl sulfate de sodium |
|
|
|
|
Chlorhydrate de laurylamine |
|
|
14.10-3 |
|
Alcool laurique à 5mol.d’oxyde d’éthylène |
|
0,57.10-3 |
|
|
Alcool laurique à 12 mol.d’oxyde d’éthylène |
|
0,14.10-3 |
|
Réf. du tableau : Jean Poré ‘’Emulsions, microémulsion, émulsions multiples’’, Les éditions techniques des corps gras, Neuilly, 1992
Bien que ce tableau ne soit exhaustif, il montre, néanmoins, la dépendance de la CMC vis-à-vis de la température.
Concentration micellaire critique micellaire et longueur de chaîne du tensioactif
Lorsqu’il s’agit de série homogène de tensioactifs à chaîne linéaire, à température constante, il a été montré expérimentalement que la CMC double chaque fois que l’enchaînement carboné de la partie hydrophobe supportant la même tête hydrophile est diminuée d’un atome de carbone. Ce point sera développé dans le second article qui paraitra dans le prochain numéro de la newsletter dans la rubrique Guide de l’Ennoblisseur.
Conclusion
La première partie de cet article est consacrée à des notions générales sur les tensioactifs, en focalisant sur les définitions, la classification, les propriétés et les domaines d’utilisations. L’approche est plus ou moins théorique mais sans entrer dans les détails mathématiques. Ce choix est justifié par le fait que le sujet doit rester simple et en même temps orienté vers les élèves ingénieurs et techniciens du textile. Le développement de la seconde partie de l’article se focalisera davantage sur la quantification des phénomènes et établira les corrélations les grandeurs physiques traitées.